显微光学成像是什么概念?
显微光学成像,通常也称“光学显微成像”,或“光学显微术”,是指透过样品或从样品反射回来的可见光,通过一个或多个透镜后,能够得到微小样品的放大图像的技术。所得图像可以通过目镜直接用眼睛观察,也可以用感光板或数字化图像探测器如CCD、CMOS进行记录,还可以在计算机上进行显示和分析处理。
采用明场照明方式的普通光学显微术通常存在三个方面的局限性:一是只能对深色样品(透射型)或强反光样品(反射型)进行成像;二是光学衍射极限限制了该技术的最高分辨率约为200 nm;三是离焦信息会降低图像对比度。基于样品中(外源或内源)荧光分子的激发和荧光发射的荧光显微术,可以突破无法对透明样品成像的局限,但分辨率受限和离焦干扰的问题仍需要采取其他措施才能加以解决。
对于无色透明样品,例如未经任何处理的活细胞,采用普通的光学显微术一般会由于缺乏足够的对比度而无法直接观察和成像,原因是这些样品的内部结构并不会导致照明光强的吸收,从而不能形成有效的图像衬度。通常的做法是利用一些特异性染料来标记样品中的不同结构以提高图像对比度,但是染色过程往往会改变甚至破坏样品,从而难以得到样品本身的真实信息。然而,采用一些改进的技术,可以使该局限性得到一定程度的改善。这种技术大致可分成两类,一类是通过改变照明方式来实现,另一类则是通过将样品对照明光相位的改变量转变为光强分布来实现,后者通常称为“相衬法”。
1、照明方式
(1)明场照明
明场照明是光学显微术中最简单的一种方式。在倒置显微镜中,只需采用白光从样品下方照射,在样品上方观察透射光即可,图像对比度取决于样品不同部位对光的吸收。采用这种方式最大的缺点是大多数生物样品的对比度都很低,并且会由于离焦信息的干扰导致分辨率也较低。但优点是设备简单,样品也无需进行繁琐的处理。
(2)斜照明
相比明场照明,斜照明方式的优点是能够使样品的图像产生一种三维(3D)的效果,从而突显出样品中一些原本看不到的结构。目前常用的“霍尔曼调制对比度”技术就是基于斜照明方式发展起来的,一般用在细胞培养室中使用的倒置显微镜上。但采用斜照明方式并不能显著提高对比度和分辨率。
(3)暗场照明
采用暗场照明方式的暗场显微术通过采集样品散射的光线来提高无色透明样品的图像对比度。为了只收集样品的散射光,暗场照明方式需要采用准直光源使进入像平面的透射光(未散射的部分)强度降到最低。相比另外两种方式,采用这种照明方式的技术其缺点主要在于光强较弱导致的成像时间过长。
(4)莱因伯格照明
莱因伯格照明方式实际上是暗场照明的一种特殊变体。其主要区别通过在聚光器之前插入彩色的透明滤光片,从而可以用颜色来区分样品中不同空间的成分,例如可将有结构的样品显示为红色,而均匀的背景则显示为蓝色,或者其它不同颜色的组合(效果也会有所不同)。
(5)其它照明方式
如正交偏振光照明,其衬度取决于样品不同部位对偏振光的不同旋转程度。
2、相衬法
光学显微术对无色透明样品无法直接成像的原因在于样品不改变照明光的强度分布,但实际上这些样品由于厚度和折射率的差异会改变照明光场的相位分布,只是由于人眼和探测器仅对强度敏感,不能直接记录相位信息。因此,假如能把照明光场经过样品后的相位改变量的分布转化成光强分布,就能够实现对这种样品(通常称为“相位”样品)的成像,这种技术称为“相衬法”,用于光学显微术中则形成了各种“相衬显微术”。
20世纪30年代,荷兰物理学家泽尼克(Zernike)首次提出了相衬技术(1953年获得诺贝尔奖),其原理是通过将直射光(即零频光)的相位改变±90°(即1/4波长的光程差)并适当衰减,从而使直射光和衍射光发生干涉而使像平面上的复振幅分布近似正比于物体的相位分布,将“看不见”的相位变化转化为“可见”的强度分布。在具体光路上,泽尼克相衬显微镜需要一个能够产生锥形照明光的圆环型聚光器,以及位于物镜后焦面处的一个对应于该锥形照明光通过区域的相位环。采用该技术,可以方便地实现对无染色的活细胞样品的直接观察和成像,但其缺点是不适合厚样品(上述近似关系不成立)和极微小样品(光晕现象严重)。
微分干涉相衬(DIC)显微术是目前一些较高端的倒置显微镜中通常会配备的另一种相衬技术,但相比基于泽尼克法,这种技术实现起来要相对复杂一些,也更昂贵一些。在DIC系统中,需采用两个特殊棱镜,称为渥拉斯顿棱镜,其中一个装在聚光器内,作用是将照明光分成彼此错开的寻常光和非寻常光,并使其光程差小于物镜的最高分辨率;另一个装在物镜的后焦面处,使经过样品后的两束光重新合并成一束并在像面发生干涉。在样品中折射率发生突变的地方,两束光干涉的结果会使图像产生“浮雕”的立体效果。该技术要求采用偏振光,因此光路中还包含两个偏振器,一个位于聚光器前(起偏器),另一个位于物镜后(检偏器)。
干涉反射(RIC)显微术是运用干涉原理的另一种相衬显微术,也称为“反射干涉相衬显微术”。RIC主要用于检测是否存在粘附,如细胞是否很好贴壁等。RIC系统和DIC系统的不同之处,除了探测的是反射光而不是透射光之外,所采用的棱镜也有所不同。
利用荧光分子标记细胞样品中某些特定结构或成分,用波长较短的光激发这些荧光分子使其处于高能态,再对其退激过程中所发射的波长相对较长的荧光进行显微成像,即为荧光显微术。采用该技术,不仅可以克服普通光学显微术难以直接对无色透明的细胞样品进行成像的缺点,更重要的是还能通过标记细胞中特定的结构或者分子、离子实现“功能成像”。由于离焦干扰等原因,普通宽场荧光显微术分辨率并不高,但利用一些特殊技术可以显著提高分辨率和对比度。
1、共聚焦激光扫描显微术
共聚焦激光扫描显微术(CLSM)的基本原理是利用一对共轭针孔进行“空间滤波”,将焦平面以外的杂散光滤除以提高纵向分辨率,实现非侵入式的“光学切片”。CLSM的横向分辨率约为100-200nm,纵向分辨率可达500nm,大大优于普通非共焦方式的荧光显微术;同时共焦针孔的应用也极大地提高了图像信噪比。这些优点使CLSM被广泛应用于细胞生物学的研究,尤其是亚细胞层次空间结构和功能的研究。
然而CLSM采用的是逐点扫描的成像方式,成像速度受到限制。近年来发展起来的转盘式共聚焦显微术(SDCM)仍利用CLSM的共焦针孔原理,但由于采用高速旋转的转盘实现了非常多焦点的近似面照明,所得荧光可以采用CCD采集,在保持图像质量达到传统CLSM水平的同时成像速度可达视频要求,成为活细胞内单分子荧光成像的有力工具。
当一束光从光密介质射向光疏介质时,并且入射角大于临界角时,将发生全内反射(TIR)。由于光的波动效应,此时仍会有少量光能量穿透界面并沿着平行界面的方向传播,称为隐失波(Evanescent Wave),全内反射荧光显微术(TIRFM)就是利用这种隐失波来激发样品荧光的,由于其穿透深度一般只有100-200 nm,因而纵向分辨率和图像信噪比均大大提高。常见的TIRFM有棱镜型和物镜型两类。TIRFM一般应用于研究细胞膜或膜内附近区域的动态过程,如信号转导等。
3、荧光共振能量转移
荧光共振能量转移(FRET)是指两个不同荧光分子(或荧光团)之间发生的非辐射能量转移。提供能量与接受能量的荧光分子分别称为供体(Donor)和受体(Acceptor),FRET效应强烈依赖于两者之间的距离(不超过10 nm),同时要求供体发射光谱与受体激发光谱有一定重叠,此时若激发供体,供体会通过FRET效应将能量转移给受体,导致供体的荧光强度比其单独存在时要低得多,而受体荧光却大大增强。利用该效应进行成像,可实现非常高的空间分辨率(nm量级),从而突破光学衍射极限的限制。利用FRET技术即可以研究分子之间的相互作用,也可以研究单分子内两亚基之间的结合或分子构象的改变等。在实际应用中,FRET技术结合前面提到的SDCM、TIRFM等技术,可用于活细胞内单分子荧光成像的研究。
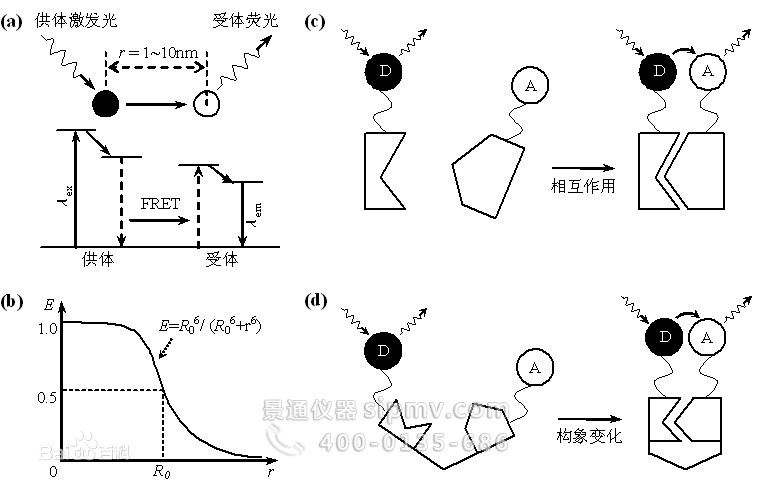 分子间(上)和分子内(下)荧光共振能量转移原理示意图
分子间(上)和分子内(下)荧光共振能量转移原理示意图
三、超分辨率技术
上述几种技术除了FRET可以从物理机制上突破光学衍射极限外,其他技术的分辨率仍然是受其限制的。近十年来,科学家们又发展了多种能够一定程度上突破该限制的新技术,统称为“超分辨技术”,主要有三类:结构光照明显微术(SIM)、受激辐射耗尽显微术(STED)和单分子定位和构图技术(SMLC),其中单分子定位技术又包括光激活定位显微术(PALM)和随机光学重建显微术(STORM)两种。采用这些超分辨率技术之后,成像效果相比传统的宽场荧光显微术甚至CLSM和TIRFM等均有显著提高,目前文献报道的横向分辨率已经达到20-30 nm左右。
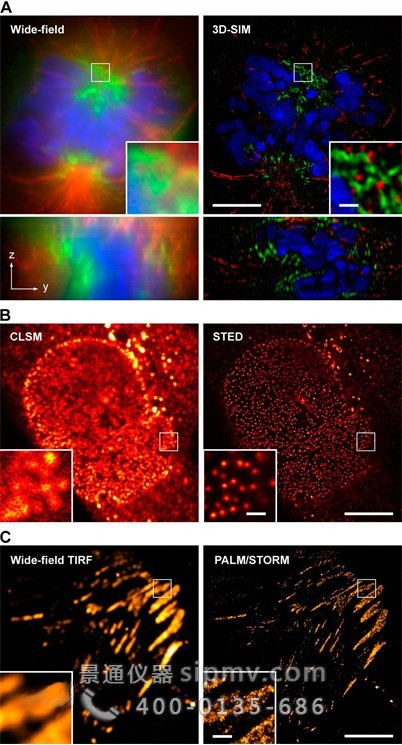 超分辨率显微术和传统高分辨率显微术的成像效果比较
超分辨率显微术和传统高分辨率显微术的成像效果比较
版权属于:景通仪器 - 国内领先的显微镜与显微数字成像解决方案供应商
转载时必须以链接形式注明作者和原始出处及本声明。
本文地址:http://www.sipmv.com/support/faq/2057/

 共聚焦激光
共聚焦激光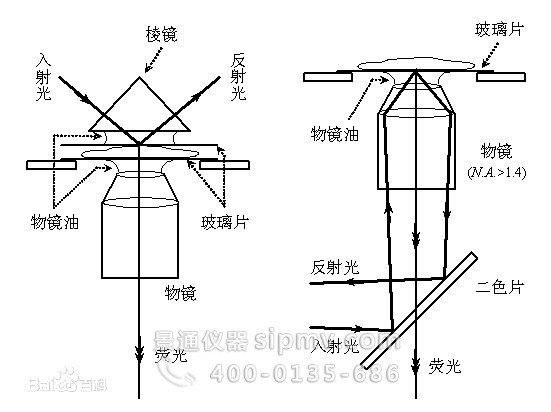 棱镜型(左)和
棱镜型(左)和